La corrosione galvanica è un fenomeno chimico-fisico che interessa i metalli e le loro leghe quando vengono a contatto con un elettrolito e sono connessi elettricamente a un metallo diverso. Questo tipo di corrosione è di particolare rilevanza nell’ingegneria dei materiali, nella conservazione delle opere metalliche e in molte applicazioni industriali e marine. Per comprendere appieno la corrosione galvanica, è necessario esplorarne i meccanismi, le cause, le conseguenze e le strategie di prevenzione.
I Meccanismi
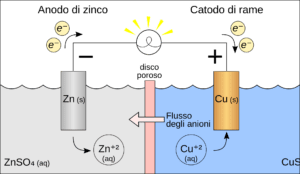
La corrosione galvanica si verifica quando due metalli diversi, o leghe metalliche, sono posti in contatto elettrico in presenza di un elettrolito, che può essere un liquido conduttore come l’acqua salina. I metalli coinvolti hanno potenziali elettrochimici differenti. In questa coppia galvanica, il metallo con il potenziale più negativo diventa l’anodo e si ossida, cedendo elettroni, mentre il metallo con potenziale più positivo agisce come catodo e riceve elettroni.
L’anodo subisce una graduale dissoluzione, con perdita di materiale, mentre il catodo rimane generalmente intatto o addirittura può essere protetto dalla reazione galvanica. La velocità con cui avviene la corrosione galvanica dipende dalla differenza di potenziale tra i due metalli, dalla conduttività dell’elettrolito e dalla resistenza del circuito elettrico complessivo.
Alcuni Metalli Comunemente Soggetti
- Acciaio
- Ferro
- Rame
- Alluminio
- Zinco
Fattori che Influenzano la Corrosione Galvanica
Diversi fattori influenzano la velocità e l’intensità della corrosione galvanica, tra cui:
- Natura dei metalli: La differenza nei potenziali standard di elettrodo dei metalli coinvolti è cruciale. Maggiore è la differenza, maggiore è il rischio di corrosione accelerata dell’anodo.
- Area dei metalli: Se l’area dell’anodo è piccola rispetto a quella del catodo, la corrosione procede più rapidamente a causa della maggiore densità di corrente all’anodo.
- Condizioni dell’elettrolito: La temperatura, la concentrazione di sali, il pH e la presenza di ossigeno influenzano la conduttività dell’elettrolito e quindi la velocità di corrosione.
- Distanza tra i metalli: Una minore distanza tra i metalli in una coppia galvanica può aumentare la velocità di corrosione a causa della ridotta resistenza del percorso elettrico.
Prevenzione e Contrasto della corrosione
- Selezione dei materiali e design compatibile
- Protezione catodica (anodi sacrificabili)
- Rivestimenti protettivi e pitture
- Controllo e manutenzione periodica
Nichelatura Chimica come Soluzione alla corrosione elettrolitica
- Formazione di una barriera protettiva
- Proprietà del rivestimento di nichel (es. uniformità, resistenza alla corrosione)
- Applicazioni tipiche (componenti elettronici, parti automobilistiche)
- Approfondisci il processo di Nichelatura Chimica
Approfondisci ogni forma di corrosione su Wikipedia
